有机叠氮化合物在合成化学中是一类重要的合成砌块,特别是结合了金属催化的“click反应”之后,其可被广泛地应用于化学生物学、材料科学、药物研究等领域。其中的一类a-羰基叠氮化合物因其同时含有羰基及叠氮基等重要官能团,是合成含氮杂环及a-氨基酮(醇)的重要中间体;同时,研究发现其本身也具有一定的生物活性(Scheme 1a)。因此,该类化合物的合成,特别是通过不对称催化方法来合成自然吸引了合成化学工作者极大的研究兴趣。目前为止合成手性a-羰基叠氮化合物,文献中已报道的方法学主要有(a)不对称亲电叠氮化;(b)氧化条件下的不对称亲核叠氮化;(c)不对称亲卤亲核取代反应(SN2X);(d)不对称自由基反应等(Scheme 1b)。通过这些已报道的文献,我们发现其构建的手性产物主要局限为a-位杂季碳手性中心的羰基叠氮化物,目前为止尚未有通过不对称叠氮化方法来直接构建a-位杂叔碳手性中心的相关羰基叠氮衍生物的文献报道。这种不足之处的主要问题在于(1)当手性中心含有吸电子性质的羰基与叠氮基时,手性中心的C-H键酸性变强,此时产物将对碱性反应条件十分敏感,易通过烯醇互变异构而消旋化或分解;(2)若利用文献中报道的其他方法,比如,通过氧化条件下的不对称亲核叠氮化合成时,反应的化学选择性将难以控制,极易生成非手性的双叠氮化副产物;(3)由于存在潜在的背景反应,反应过程中的立体选择性调控将更具挑战。基于此,如何建立温和的反应条件是通过不对称叠氮化合成a-位含杂叔碳手性中心的羰基叠氮衍生物的基础与前提。
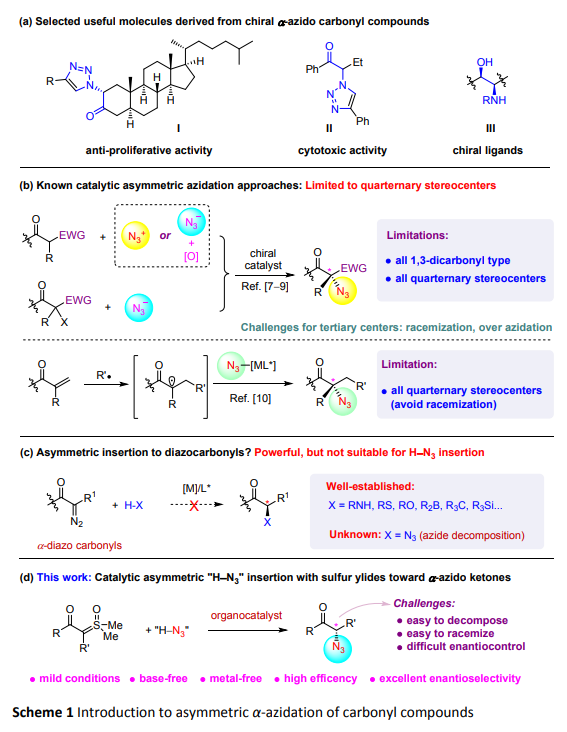
过渡金属催化的金属卡宾对极性H-X键的不对称插入反应是有机合成中一种构建杂叔碳手性中心的强有力的方法,但该类方法目前仍无法适用于对H-N3的不对称插入反应(Scheme 1c)。郭文岗博士和孙建伟教授课题组合作通过利用氧化硫叶立德的不对称叠氮化反应实现了构建含a-杂叔碳手性中心的羰基叠氮化合物,利用Jacobsen方酸酰胺作为有机催化剂,苯甲酸作为质子源,TMSN3作为叠氮源,实现了该类产物的不对称催化合成,反应反应条件温和,所获得的产物绝大部分具有优异的对映体选择性和良好的分离收率。经过详细的机理研究,该反应体系具有以下特征:
1.催化剂方酸酰胺的两个NH键对底物活化和立体选择性至关重要,核磁滴定实验证明底物与催化剂之间存在着强烈的氢键相互作用,且该相互作用是可逆的。
2.反应机理仍为动态动力学拆分,C-N3键的生成既是决速步又是对映体选择性决定步,质子源添加剂和TMSN3的相互反应仅用于原位产生HN3,其不参与底物活化或参与对映体选择决定步,该机理同时得到DFT计算结果的支持。
3.氧化硫叶立德可被稀HCl质子化,利用核磁可首次观察到该类硫鎓盐,但该硫鎓盐与NaN3相互作用产生HN3和重新生成氧化硫叶立德,进一步间接佐证了质子化过程的可逆性;
4.在以上机理研究结果导向下本反应可以使用稀盐酸和NaN3作为更加廉价的质子和叠氮源,反应产物的对映体选择性基本保持不变。
该研究成果最近发表于Chemical Science,郭文岗博士为第一作者和通讯作者。此论文为郭文岗博士2021年4月入职我校以来在我校认定的化学类高水平期刊上以常州大学为第一单位发表的第二篇研究论文。
论文链接地址:https://pubs.rsc.org/en/content/articlepdf/2022/sc/d2sc03552a




